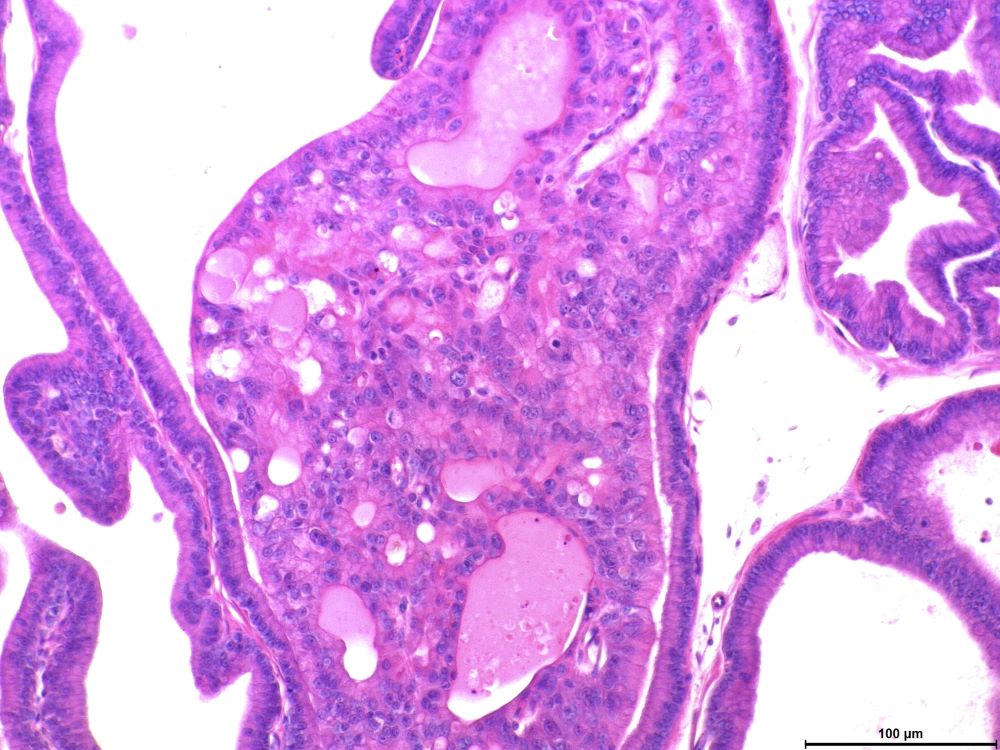
Experimentos com ratos conduzidos por pesquisadores da Universidade Estadual Paulista (Unesp) ajudam a entender por que descendentes de mulheres submetidas a uma dieta carente de proteínas durante a gravidez tendem a apresentar maior risco de câncer de próstata na vida adulta.
Em um primeiro estudo, conduzido com apoio da Fapesp, foram identificadas alterações na expressão gênica possivelmente relacionadas com o desequilíbrio hormonal observado na prole e o aumento no risco da doença.
“A carência de proteína durante os períodos de gestação e amamentação desregula as vias moleculares envolvidas no desenvolvimento normal da próstata, levando ao comprometimento de seu crescimento na prole jovem. Isso já se sabia [leia mais em: agencia.fapesp.br/28356]. Agora, identificamos que uma dieta carente em proteína durante a fase embrionária e os dois primeiros anos de vida altera a expressão de mais de 700 genes na prole, entre eles o gene ABCG1, relacionado ao câncer de próstata”, relata Luis Antônio Justulin Junior, professor do Instituto de Biociências de Botucatu (IBB-Unesp) que liderou os trabalhos.
Em um segundo estudo, os cientistas demonstraram que a desregulação de um tipo específico de RNA (micro-RNA-206) está relacionada ao aumento do hormônio estrógeno já no início da vida – uma característica marcante da prole de ratas que tiveram carência de proteína durante a gestação e lactação e que está associada ao aumento de risco de câncer de próstata.
“Os resultados mostram, mais uma vez, como a alimentação e tudo mais que acontece nas fases iniciais de desenvolvimento são determinantes para moldar a trajetória de saúde e doença dos filhos. Esse conceito também explora o que chamamos de os mil primeiros dias de vida – fase que compreende o período de gestação, amamentação e vai até os dois anos de idade do bebê”, afirma Justulin.
Determinante para toda a vida
Estudos que relacionam a saúde da gestante com o desenvolvimento dos filhos têm sido conduzidos nas últimas décadas, sobretudo em uma área de pesquisa denominada “origens desenvolvimentistas da saúde e doença” (DOHaD, na sigla em inglês). Há fortes evidências de que a interação gene-ambiente inadequada durante a fase embrionária e os dois primeiros anos de vida pode ser um fator importante para o aumento da incidência de doenças crônicas não transmissíveis ao longo da vida, como câncer, diabetes, doenças respiratórias crônicas e cardiovasculares.
Estudo internacional divulgado em 2009 demonstrou a existência de um risco aumentado de câncer de próstata em homens judeus expostos desde muito cedo à fome e aos horrores do Holocausto. A esse efeito do ambiente desfavorável (por exemplo, a má alimentação materna) sobre a expressão gênica dá-se o nome de epigenética. Nesses casos, não há alteração na sequência de DNA (ou, seja, não há mutação genética) e sim uma mudança na expressão de alguns genes na prole. E o novo padrão pode até mesmo ser transmitido para as próximas gerações.
O trabalho feito na Unesp investigou os mecanismos celulares envolvidos nesse processo nos testes com ratos. Parte dos resultados foi divulgada na revista Scientific Reports. O artigo descreve o perfil de expressão global de microRNAs e RNAs mensageiros e aponta quais alterações moleculares estariam associadas ao maior risco de câncer de próstata.
Vale destacar que cabe aos microRNAs modular, por meio de mecanismos epigenéticos, a expressão dos RNAs mensageiros – aqueles responsáveis pela síntese de proteínas. Dessa forma, os microRNAs são fatores importantes na expressão genética.
Por meio de sequenciamento de RNA e análises de bioinformática, os pesquisadores identificaram a desregulação de um microRNA (miR-206) e de seu gene-alvo (PLG) tanto na próstata de ratos jovens como em animais velhos expostos à restrição proteica no útero e que desenvolveram o câncer. Segundo os autores, a desregulação nesse micro-RNA pode ser uma resposta ao aumento de estrógeno já no início da vida.
“Também identificamos que miR-206 modula a expressão do receptor de estrógeno alfa, que está sendo relacionado justamente com o maior risco de desenvolvimento de câncer de próstata na fase adulta”, conta o pesquisador.
Justulin explica que, além de no começo da vida os animais analisados apresentarem diferença de desenvolvimento e crescimento glandular, foi observado um desequilíbrio hormonal. “Esses animais tinham maior nível de estrógeno, que, ao longo do envelhecimento, subia ainda mais, enquanto os níveis de hormônios andrógenos caíam. E esse desequilíbrio hormonal está relacionado com o desenvolvimento de câncer de próstata humano”, diz.
O artigo publicado em Scientific Reports foi premiado no primeiro Congresso DOHaD Brasil, realizado pela Associação DOHaD Brasil.
Gene-alvo
Em um segundo artigo, publicado na revista Molecular and Cellular Endocrinology, o grupo descreve alterações em mais de 700 genes na próstata da prole, identificadas por meio de técnicas de RNA-seq, que permitem medir a expressão de vários genes ao mesmo tempo. Com isso, é possível obter o transcriptoma, ou seja, o conjunto completo de moléculas de RNA expressas em um tecido.
Ao correlacionar as informações obtidas no estudo com as de um banco de dados sobre câncer de próstata humano, os pesquisadores identificaram o gene ABCG1 (um dos alterados) como potencial “gene DOHaD” associado a distúrbios no desenvolvimento da próstata com efeitos duradouros a ponto de aumentar o risco de câncer.
“Demonstramos que as mudanças no perfil de expressão gênica persistem ao longo da vida, predispondo os ratos a desenvolver câncer de próstata com o envelhecimento. Curiosamente, identificamos marcadores moleculares comumente desregulados entre ratos jovens e velhos com aqueles observados em pacientes humanos com a doença. No geral, esses dados destacam a desnutrição materna como um fator ambiental-chave envolvido nas origens do desenvolvimento do câncer de próstata na prole de ratos”, conclui o pesquisador.
O post Estudo de SP explica por que dieta pobre em proteína na gestação eleva risco de câncer apareceu primeiro em Governo do Estado de São Paulo.